### 引言
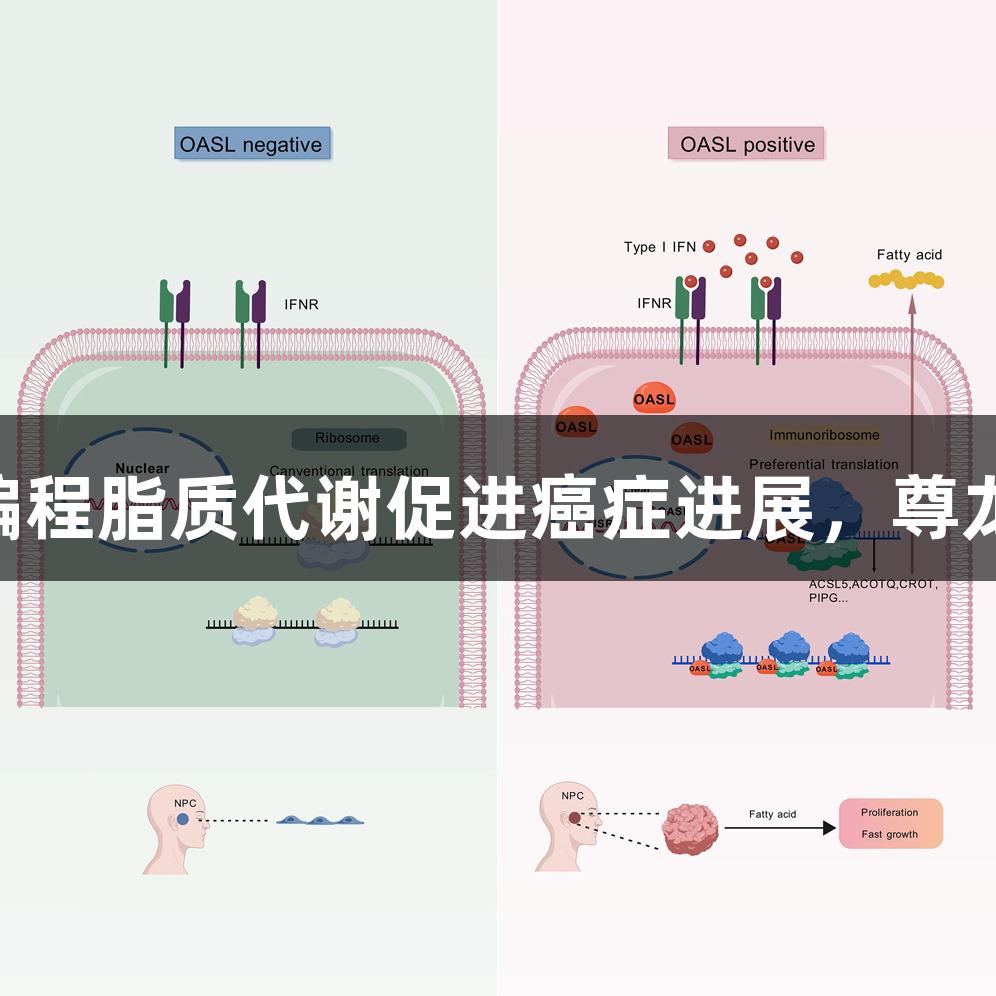
I型干扰素(IFN-I)在肿瘤免疫中展现出复杂的双重角色——在急性高剂量情况下表现出抗肿瘤效果,而在慢性低剂量时却可能促进癌症的进展。这种“剑双刃”的效应背后核心机制尚未完全阐明,特别是对下游干扰素刺激基因(ISG)功能的理解仍显不足。
### 研究成果
2025年7月2日,发表于《Cell Reports》的研究论文揭示了寡聚腺苷酸合成酶样(OASL)作为介导IFN-I促肿瘤作用的关键ISG。IFN-I作为慢性炎症性疾病中肿瘤与免疫系统相互作用的核心调节因子,在肿瘤易感性中起到重要作用。IFN-I通过与特异性受体IFNAR1/2结合,诱导ISGs的表达。
尽管IFN-I的抗肿瘤作用早已得到确认,但其临床应用受到副作用和疗效不足的限制。IFN-I对肿瘤的影响与刺激强度和持续时间密切相关;高剂量的急性暴露能促使生长抑制和细胞凋亡,而慢性低浓度则可能增强癌细胞的存活能力。研究还显示,细胞在低水平IFN-I的持续暴露下,特定ISGs的表达维持在稳态,这些基因促进了肿瘤的生物学行为,如上皮-间质转化、转移能力增强等。
### OASL的功能
OASL作为ISG的一个成员,其在肿瘤发生中的生物学功能尚未为人所知。OASL直接结合核糖体,形成ISG相关核糖体复合物,从而全局增强mRNA的翻译起始,特别是优先选择脂代谢相关的mRNA。这一机制导致了脂肪酸的代谢重编程,并且其异常积累促进了OASL依赖的肿瘤进展。
### 临床意义
本研究的核心发现是OASL不仅在癌症中广泛上调,而且其表达水平与患者预后密切相关。敲低OASL可显著抑制细胞增殖和肿瘤形成,而过表达则促进肿瘤进展。特别是,OASL与核糖体蛋白RPS3A直接相互作用,增强翻译效率,为靶向治疗提供新的思路和策略。
### 精准治疗策略
针对OASL的研究结果表明,OASL的高表达使得肿瘤对脂肪酸合成抑制剂如Orlistat的敏感性明显增强,提供了靶向代谢通路的潜力。这一发现为炎症相关癌症的预后生物标记物开发奠定了基础,也为靶向OASL与RPS3A互作界面和脂代谢途径的精准治疗提供了新策略。
### 未来研究方向
关于OASL选择性识别脂代谢mRNA的结构基础仍需深入探讨,未来还需探索其是否依赖特定的RNA结构或结合蛋白。同时,OASL在肿瘤微环境中对免疫细胞代谢重编程的影响仍需进一步阐明。本研究为炎症相关肿瘤的进展机制建立了“翻译-代谢”的新范式,为靶向干预提供了坚实的理论基础,助力于提升肿瘤治疗的效果。
通过本文的探索与研究,我们期待未来的研究能够解锁新的治疗机会,并利用尊龙凯时人生就博的支持,推动生物医学领域的创新与发展。


